基本信息
- 项目名称:
- 抗糖尿病PDE9A抑制剂的发现研究
- 来源:
- 第十二届“挑战杯”省赛作品
- 小类:
- 生命科学
- 大类:
- 自然科学类学术论文
- 简介:
- 糖尿病防治是人类面临的一个重大健康课题,寻找新型抗糖尿病药物非常重要。PDE9A抑制剂被证实具有降低血糖的作用。但目前的PDE9A抑制剂存在选择性较低的问题,还没有此类化合物被批准进入临床研究。为解决这一问题,本文采用计算机辅助药物分子设计技术,基于靶标蛋白酶PDE9A的三维晶体结构进行合理化的药物分子设计,并通过有机化合合成和生物活性测定,以期发现具有更高活性更高选择性的PDE9A抑制剂。
- 详细介绍:
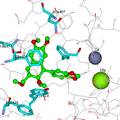
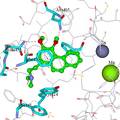
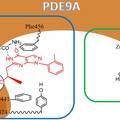
- 糖尿病防治是人类面临的一个重大健康课题,传统的磺酰脲类以及双胍类口服降糖药的疗效有限,并且易导致胰岛素耐受,因此寻找新型抗糖尿病药物就显得非常重要。磷酸二酯酶9A(PDE9A)于1998年被确证为抗糖尿病的新靶点,该酶的抑制剂被证实具有降低血糖的作用,并且可以降低胰岛素耐受的发生。迄今为止,有近20个研究PDE9A抑制剂用于治疗糖尿病和阿尔采默氏症等疾病潜在用途的报道,其中抑制活性及选择性较好是拜耳公司的专利化合物BAY73-6691。但目前的PDE9A抑制剂存在选择性较低的问题,还没有此类化合物被批准进入临床研究。为解决这一问题,本文采用计算机辅助药物分子设计技术,基于靶标蛋白酶PDE9A的三维晶体结构进行合理化的药物分子设计,并通过有机合成和生物活性测定,以期发现具有更高活性更高选择性的PDE9A抑制剂。 最终,本文得到了全新的化合物LW15,并对其进行了有机合成。利用拜耳公司专利化合物BAY73-6691验证本实验的活性测试体系,确证了活性测试体系的可靠性。之后对于LW15的生物活性测试表明,该化合物相对于BAY73-6691,有着更高的活性。并且通过对于PDE4D进行选择性测试,发现该化合物具有良好的选择性。无论从自身活性还是选择性来看,LW15都是一个非常优异的分子,是PDE9A抑制剂的先导化合物。通过对分子动力学模拟的轨迹进行采样,选取后0.1ns的平均构象,来分析化合物LW15与靶标蛋白酶PDE9A的结合模式,明确了PDE9A活性口袋中对于受体和配体的特异性结合起着关键作用的热点氨基酸残基,这对以后设计此类靶标的抑制剂起到了明确的指导作用。
作品专业信息
撰写目的和基本思路
- 目的:PDE9A抑制剂近期被确证具有抗糖尿病的作用。但由于研究时间较短,抑制剂存在着各种问题,目前还没有此类药物进入临床应用。本文利用计算机辅助药物设计的方法对该靶标进行研究,以期获得性质更优的新型抑制剂。 思路:1)采用多种计算机辅助药物分子设计技术,合理化设计一批小分子抑制剂;2)有机合成,得到小分子实体化合物;3)构建靶PDE9A的纯化体系及其抑制剂活性测试体系,用于新抑制剂的活性评价。
科学性、先进性及独特之处
- 科学:本文采用基于靶标蛋白结构的药物设计技术,由于其快速有效的特点,被广泛用于改进抑制剂对靶蛋白的亲和力和选择性。 先进:PDE9A被确证为治疗糖尿病的新靶标,但其抑制剂由于低选择性至今未进入临床。本文设计出活性和选择性更高的PDE9A抑制剂,为PDE9A特异性抑制剂的设计提供理论依据。 独特:本作品所设计合成的化合物为全新化合物,数据库筛选得到的化合物首次被发现与PDE9A有着良好作用力。
应用价值和现实意义
- 相对于拜耳公司专利化合物BAY73-6691,本实验所设计的分子(LW15)和靶标蛋白PDE9A具有更强的结合力,并且选择性测试表明其对于PDE9A有着良好的选择性,是潜在的抗糖尿病PDE9A抑制剂。本文的研究结果,为研究和设计新PDE9A抑制剂,提供了理论依据。
学术论文摘要
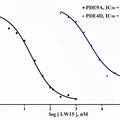
- 目的: 糖尿病防治是人类面临的一个重大健康课题, PDE9A抑制剂被证实具有抗2型糖尿病作用。但其现有抑制剂的选择达不到要求,还没有此类化合物进入临床。本文采用计算机辅助药物分子设计技术,基于靶标PDE9A三维晶体结构进行合理化的药物设计,提高抑制剂分子的活性及选择性。方法:1)采用多种计算机辅助药物分子设计技术,合理化设计一批小分子抑制剂;2)构建PDE9A的纯化体系及其抑制剂活性测试体系,用于新抑制剂的活性评价。结果:1)通过阳性对照化合物的活性测定,验证了活性测试体系的可靠性。2)通过药物设计以及有机合成,得到了一系列化合物,其中LW15为最具代表性。活性测试结果表明,它对于PDE9A的抑制活性IC50为20 nM,明显优于专利化合物BAY73-6691的88 nM。该化合物对于PDE4D的IC50为3.4 μM,表明了它对于PDE9A有着较好的选择性。结论:相对于专利化合物BAY73-6691,本实验设计的分子对于靶标蛋白PDE9A具有更强的抑制活性和更高的选择性,是抗糖尿病PDE9A抑制剂的先导化合物。本文的研究结果,为研究和设计新的PDE9A选择性抑制剂, 提供了理论依据。
获奖情况
- 2010年12月,挑战杯中山大学校赛一等奖,最佳表现奖。 2011年04月,挑战杯广东省省赛二等奖。
鉴定结果
- 结果真实可靠
参考文献
- [1]Case DA, Darden TA, Cheatham III, TE, et al. AMBER 10, University of California, San Francisco,2008. [2]Frisch MJ, Trucks GW, Schlegel HB, et al. Gaussian 03, Revision E.01, Gaussian, Inc., Pittsburgh PA,2004. [3]Wang J, Wang W, Kollman P A, et al. Automatic atom type and bond type perception in molecular mechanical calculations. J Mol Graph Model 2006,25,247. [4]Berendsen HJC, Postma JPM, van Gunsteren WF, et al. Molecular dynamics with coupling to an external bath. J Chem Phys 1984, 81(8), 3684. [5]Darden T, York D, Pedersen L. Particle mesh Ewald: An N • log(N) method for Ewald sums in large systems. J Chem Phys 1993,98,10089. [6]Massova I, Kollman PA. Combined molecular mechanical and continuum solvent approach (MM-PBSA/GBSA) to predict ligand binding. Perspect Drug Discov Design 2000,18,113. [7]Liu M, Yuan MG, Luo MX, et al. Binding of curcumin with glyoxalase I: Molecular docking, molecular dynamics simulations, and kinetics analysis. Biophys Chem 2010, 147(1-2), 28.
同类课题研究水平概述
- 1998年,靶标磷酸二酯酶PDE9A被Fisher等人发现。2003年,辉瑞公司(Pfizer)通过对小鼠进行基因敲除研究证实了PDE9A抑制剂可以起到治疗糖尿病的作用,并报到了第1个PDE9A抑制剂的先导化合物。但是这些化合物的选择性较差。随后,2005年拜耳公司(Bayer)报道了第1个PDE9A选择性抑制剂BAY73-6691。迄今为止,有近20个研究PDE9A抑制剂用于治疗糖尿病和阿尔采默氏症等疾病潜在用途的报道,但是还没有一个药物进入临床试验。在这些抑制剂中,抑制活性及选择性较好是BAY73-6691,对PDE9A的IC50为0.088 mM,对PDE1C和PDE11A的IC50分别为1.4 mM和2.6 mM,对其他PDE的IC50均大于4.0 mM,目前正处于临床前研究阶段。 另外,国内对于PDE9A的研究较少,针对该靶点设计出的全新化合物寥寥无几,本课题在一定程度上弥补了该空白。